![]()
BENOÎT CORRIVEAU, EVE GUILLOTTE /
Eve Guillotte, médecin de famille et coordonnatrice médicale, Programme Cran, Direction des programmes santé mentale et dépendance, CIUSSS Centre-Sud-de-l’Île-de-Montréal
Correspondance
Benoît Corriveau
Programme Cran, Direction des programmes santé mentale et dépendance
Centre intégré universitaire de santé et de services sociaux du Centre-Sud-de-l’Île-de-Montréal
110, rue Prince-Arthur Ouest
Montréal (Québec) H2X 1S7
benoit.corriveau.ccsmtl@ssss.gouv.qc.ca
Résumé
Malgré les efforts déployés par différents acteurs de la société pour s’attaquer à la crise des opioïdes au cours des dernières années, la contamination des drogues de rue par le fentanyl continue de causer de nombreux décès par surdoses au Canada. Bien qu’aucune étude scientifique n’ait démontré l’efficacité de cette pratique pour réduire les surdoses, l’approvisionnement sécuritaire (safe supply), c’est-à-dire la distribution selon différentes modalités de substances psychoactives de qualité pharmaceutique qui sont d’usage dans la rue, est perçu comme un outil supplémentaire pour s’attaquer à cette épidémie. Le gouvernement canadien a d’ailleurs lancé un appel de propositions ainsi que des investissements de 33 -millions de dollars pour le développement de programmes d’approvisionnement sécuritaire en juillet 2019.
Cet article s’intéresse au volet médical de cette pratique émergente dans la prise en charge des troubles liés à l’usage des opioïdes chez les populations désaffiliées ou à haut risque de surdoses : la pharmacothérapie de remplacement des opioïdes. Cette approche, qui adapte le traitement encore plus loin dans la perspective de la réduction des méfaits, tente de répondre aux besoins des personnes pour lesquelles l’abstinence ne constitue pas un objectif réaliste à court terme, mais qui restent à risque de complications et de surdoses dans le contexte actuel. L’offre de ce traitement alternatif vise à favoriser les contacts entre les personnes qui utilisent des drogues (PUD) et les services sociaux et de santé, maximiser la rétention en traitement et réduire les risques liés à la consommation. Au-delà de la réflexion théorique, nous illustrons, à l’aide de cas réels d’un service bas seuil de traitement du trouble de l’usage des opioïdes du centre-sud de Montréal, les bénéfices observés, mais aussi les enjeux cliniques et légaux liés à cette pratique.
Mots-clés : approvisionnement sécuritaire, pharmacothérapie de remplacement, opioïdes, trouble lié à l’usage des opioïdes, réduction des méfaits, traitement agoniste opioïde
The emerging practice of substance replacement therapy
Abstract
Despite efforts by various societal actors to address the opioid crisis in recent years, fentanyl contamination of street drugs continues to cause many overdose deaths in Canada. Although no scientific studies have demonstrated the effectiveness of this practice in reducing overdoses, safe supply, the distribution of pharmaceutical grade psychoactive substances used on the street through various modalities, is seen as an additional tool to address this epidemic. Last July, the Canadian government issued a call for proposals and investments of $33 million for the development of safe supply programs.
This article focuses on the medical component of this emerging practice in the management of opioid use disorders in disaffiliated populations or populations at high risk of overdose: opioid replacement therapy. This approach, in which we adapt treatment goals even further into a harm reduction perspective, attempts to address the needs of people for whom abstinence is not a realistic short-term goal, but who remains at risk of complications and overdose in the current context. The offer of this alternative treatment aims to promote contact between people who use drugs and health and social services, maximize retention in treatment and reduce the risks associated with consumption. Beyond the theoretical reflection, we illustrate through real cases the benefits observed of the medical prescription of safe supply in a low-threshold service for opioid use disorder in south-central Montreal and discuss the clinical and legal issues related to this approach.
Keywords: safe supply, opioids, opioid use disorder, harm reduction, agonist opioid treatment
La práctica emergente de la farmacoterapia de remplazo
Resumen
A pesar de los esfuerzos desplegados por diferentes actores de la sociedad para enfrentar la crisis de los opioides durante los últimos años, la contaminación de las drogas de la calle por el fentanilo sigue causando numerosas muertes por sobredosis en Canadá. Si bien ningún estudio científico ha demostrado la eficacia de esta práctica para reducir las sobredosis, el abastecimiento seguro (safe supply), es decir, la distribución según ciertas modalidades de sustancias psicoactivas de calidad farmacéutica que se consumen en la calle, se percibe como una herramienta más para atacar esta epidemia. Por otra parte, en julio de 2019, el Gobierno canadiense ha lanzado un llamado a la presentación de propuestas y ha invertido 33 millones de dólares para el desarrollo de programas de abastecimiento seguro.
Este artículo se interesa en el aspecto médico de esta práctica emergente en el tratamiento de los trastornos relacionados con el uso de opioides en las poblaciones desafiliadas o con alto riesgo de sobredosis: la farmacoterapia de remplazo de los opioides. Este enfoque, que adapta el tratamiento todavía más lejos en la perspectiva de la reducción de los daños, busca responder a las necesidades de las personas para las cuales la abstinencia no constituye un objetivo realista a corto plazo, pero que siguen corriendo el riesgo de complicaciones y de sobredosis en el contexto actual. La oferta de este tratamiento alternativo tiene como objetivo favorecer los contactos entre quienes utilizan las drogas y los servicios sociales y de salud, maximizar la retención de personas en tratamiento y reducir los riesgos relacionados con el consumo. Más allá de la reflexión teórica, ilustramos los beneficios observados y las cuestiones clínicas y legales ligadas a esta práctica con la ayuda de casos reales de un servicio de baja exigencia de tratamiento del trastorno de consumo de opioides en el centro sud de Montreal.
Palabras clave: abastecimiento seguro, farmacoterapia de remplazo, opioides, trastorno ligado al consumo de opioides, reducción de los daños, tratamiento opioide antagonista
L’épidémie des surdoses d’opioïdes
La consommation d’opioïdes est un enjeu majeur de santé publique au Canada, en Amérique du Nord et dans le monde. Il est estimé qu’environ 16 millions de personnes dans le monde souffrent d’un trouble lié à l’usage des opioïdes (TLUO) et cela engendre la perte d’environ 11 millions d’années ajustées pour l’incapacité de vie en raison des problèmes de santé et des décès prématurés liés aux opioïdes (Degenhardt et al., 2014). Au Canada, 11 personnes décèdent et 14 personnes sont hospitalisées chaque jour en moyenne à la suite d’une surdose d’opioïdes et il est estimé qu’environ 100 000 Canadiens présentent un usage problématique des opioïdes (Santé Canada, 2017, 2020).
Le rôle de la contamination des opioïdes par le fentanyl
L’augmentation rapide des surdoses liées aux opioïdes au cours des dernières années a amené plusieurs experts à qualifier la situation d’épidémie ainsi que le gouvernement du Canada à déclarer qu’il s’agit d’une « crise nationale en santé publique » (Gouvernement du Canada, 2020). Cette épidémie, tenant ses origines de la surprescription des médicaments opioïdes, a été exacerbée par l’augmentation massive de la présence d’opioïdes synthétiques ultrapuissants – principalement le fentanyl et ses analogues – dans les drogues de rue (Wood, 2018). En effet, ces opioïdes synthétiques mettent davantage à risque de surdose et entraînent une plus grande résistance aux traitements par agonistes opioïdes standards en raison de leur effet important, même lorsqu’utilisés en petite quantité : à titre d’exemple, à poids égal, le carfentanyl est 10 000 fois plus puissant que la morphine et une dose environ 40 fois plus élevée de naloxone (antagoniste aux opioïdes utilisé comme antidote) que la dose usuelle peut être nécessaire pour renverser une surdose causée par cet analogue (Armenian et al., 2018). Bien que la surprescription médicale d’opioïdes soit l’une des causes de la crise actuelle, la réduction de la disponibilité des opioïdes prescrits – à la suite de campagnes de sensibilisation réalisées auprès des médecins – a été liée à l’augmentation des décès liés aux opioïdes de rue (Fischer, Jones et al., 2020). Ce constat alarmant pousse plusieurs professionnels à affirmer que, bien que l’initiation d’une médication opioïde doive généralement être découragée chez une personne non dépendante, l’arrêt rapide d’une prescription chez une personne qui a développé une dépendance doit également l’être, car cela peut la pousser à se tourner vers un marché noir imprévisible et dangereux. (Fischer, Pang et Jones, 2020).
Les données de surveillance épidémiologique au Canada font état d’importantes variations régionales dans la disponibilité, la demande et la contamination des opioïdes illicites. Le plus récent rapport du Service d’analyse des drogues du Canada révélait que le fentanyl ou ses analogues étaient présents dans 59,6 % des échantillons contenant des opioïdes à l’échelle nationale (12,2 % au Québec) (Service d’analyse des drogues, 2020). Bien que le fentanyl puisse être utilisé de manière intentionnelle, lorsque les gens ne savent pas qu’ils en consomment ni en quelle quantité, ils sont plus à risque de surdoses involontaires (Beletsky et Davis, 2017 ; Ciccarone, 2017). Les enquêtes menées auprès des personnes qui utilisent des drogues (PUD) par le B.C. Centre for Disease Control ont évalué qu’entre 14,0 et 36,0 % de ceux qui utilisent le fentanyl le font à leur insu ; à Montréal, cette proportion grimpait à 90,0 % selon l’évaluation de la Direction régionale de santé publique (DRSP) avant la pandémie de COVID-19 (Centre canadien sur les dépendances et l’usage de substances, 2020 ; DRSP, 2018). L’apparition sur le marché montréalais d’ « héroïne mauve » (contenant principalement ou exclusivement du fentanyl) pendant la pandémie et notre expérience sur le terrain nous poussent toutefois à croire que cette proportion pourrait être maintenant beaucoup plus basse (DRSP, 2020a, 2020b, 2020c). Entre juillet 2019 et septembre 2020, les analyses toxicologiques avaient détecté la présence de fentanyl ou de ses analogues dans au moins 11,0 % des décès reliés à une intoxication suspectée aux opioïdes ou autres drogues (proportion sous-estimée en raison de données partielles) (Institut national de santé publique du Québec [INSPQ], 2020). Or, lors de l’été 2020, quatre phénomènes inquiétants sont survenus simultanément à Montréal : l’augmentation rapide sur le marché noir de la présence du fentanyl (vendu comme du fentanyl, de l’héroïne et parfois de la cocaïne), une hausse importante des surdoses sévères nécessitant l’administration de naloxone, une hausse des décès liés à des mélanges de drogues (principalement des stimulants, et ce, dans le contexte des vagues de chaleur accablante) et l’apparition d’opioïdes de synthèse plus puissants que le fentanyl (DRSP, 2020d, 2020e, 2020f). Ainsi, bien que le Québec soit resté relativement épargné par la crise jusqu’à présent, les autorités de santé publique et plusieurs professionnels de la santé redoutent que des changements dans les chaînes d’approvisionnement du marché noir, en raison de la pandémie ou d’autres perturbations, puissent avoir eu un impact significatif sur la qualité des drogues de rue, entraînant potentiellement une augmentation massive des surdoses comme dans le reste du Canada.
Les mesures pour diminuer l’incidence des surdoses : jusqu’à présent inadaptées ?
L’augmentation alarmante du taux de surdoses liées aux opioïdes au cours des dernières années a conduit plusieurs acteurs professionnels, civils et communautaires à réclamer des actions rapides et déterminantes pour s’attaquer à cette crise de santé publique. Ainsi, de nombreuses mesures ont été prises par différents intervenants du système de la santé et des gouvernements du Québec et du Canada pour tenter de diminuer autant la prévalence que la mortalité des surdoses d’opioïdes (Ministère de la Santé et des Services sociaux [MSSS], 2018) :
- formations dans différents organismes communautaires et auprès des premiers répondants sur l’administration de la naloxone à Montréal depuis 2016 ;
- instauration d’un programme universel d’accès gratuit à la naloxone par la Régie de l’assurance maladie du Québec en 2017 ;
- adoption de la Loi sur les bons samaritains secourant les victimes de surdose par le gouvernement du Canada en 2017 (Gouvernement du Canada, 2017) ;
- retrait du statut de médicament d’exception pour la buprénorphine/naloxone par le gouvernement du Canada et transfert à la liste des médicaments remboursés par la Régie de l’assurance maladie du Québec en 2017 ;
- création des services de consommation supervisée par la DRSP à Montréal en 2018 ;
- retrait de l’exemption nécessaire pour prescrire la méthadone par le Collège des médecins du Québec (CMQ) en 2018 ;
- distribution de naloxone et de bandelettes de détection du fentanyl dans les organismes communautaires et les établissements du réseau de la santé au Québec en 2018.
Malgré le déploiement de ces nombreuses mesures, le taux de mortalité lié aux surdoses d’opioïdes peine à fléchir au Québec et au Canada depuis 2016 (INSPQ, 2020 ; Santé Canada, 2020), notamment en raison de la présence de plus en plus importante du fentanyl et ses analogues dans les drogues vendues sur le marché illicite. En effet, la proportion de surdoses d’opioïdes accidentelles mortelles causées par le fentanyl ou ses analogues est passée de 47,0 à 80,0 % de 2016 à 2019 au Canada, pendant que la proportion et le nombre absolu de surdoses mortelles causées par les autres opioïdes diminuaient de manière constante (Agence de la santé publique du Canada, 2020). C’est devant un tel portrait épidémiologique que le bureau de l’administratrice en chef de la santé publique de Colombie-Britannique déclarait en 2019 : « Il a été démontré que l’impact combiné de ces interventions a permis d’éviter 60 % de tous les décès par surdose possibles depuis la déclaration de l’urgence de santé publique. […] Malheureusement, même avec ces initiatives réussies, le nombre de personnes en Colombie-Britannique qui meurent et sont vulnérables aux surdoses reste inacceptablement élevé (traduction libre). » (Office of the Provincial Health Officer, 2019) Bien que le succès des programmes de santé publique et des traitements de la dépendance aux opioïdes actuellement utilisés ne soit pas remis en cause, plusieurs voix s’élèvent pour trouver des solutions alternatives à la présence de plus en plus importante des opioïdes synthétiques puissants dans les drogues de rues. Ces appels ont été renouvelés lors de la pandémie de COVID-19 et plusieurs organisations médicales ont émis des prises de position pour faciliter l’accès à l’approvisionnement sécuritaire (BC Centre on Substance Use, 2020 ; College of Physicians and Surgeons of Newfoundland and Labrador, 2020 ; Institut universitaire sur les dépendances, 2020).
Enjeux du traitement du trouble lié à l’usage des opioïdes et pratiques émergentes
Traditionnellement, les traitements pharmacologiques du TLUO sont basés sur l’utilisation de médications opioïdes à longue durée d’action, dites agonistes, pour permettre un arrêt sécuritaire de l’utilisation des drogues de rue sans apparition de symptômes de sevrage (Strain, 2020).
L’objectif du traitement par agoniste opioïde (TAO) n’est pas nécessairement d’arrêter l’utilisation de tout opioïde, mais de réduire l’utilisation des opioïdes illicites qui rendent plus à risque de surdoses en raison de la variabilité des molécules s’y retrouvant et de leur concentration. Au-delà de la diminution de la consommation d’opioïdes illicites, les bénéfices du TAO sont multiples et largement documentés. En permettant de réduire les complications reliées à la consommation et en favorisant le contact avec des professionnels de la santé, les TAO :
- diminuent le risque de contracter et de transmettre des infections comme le VIH et l’hépatite C (Connery, 2015 ; Gowing et al., 2006 ; Tsui et al., 2014) ;
- réduisent le taux de criminalité et d’incarcération (Gisev et al., 2019 ; National Institute on Drug Abuse [NIDA], 2020) ;
- diminuent le taux de mortalité global (Pearce et al., 2020).
Les molécules recommandées par le CMQ sont la buprénorphine/naloxone en première intention, la méthadone en deuxième intention et la morphine orale à libération lente uniquotidienne pour les cas réfractaires (CMQ, 2020). Bien que la longue durée d’action de ces traitements soit un avantage pour la plupart des patients, en permettant de contrôler les symptômes de sevrage et les envies de consommer (cravings) avec une seule prise par jour, l’utilisation de ces molécules n’est pas adaptée à toutes les PUD. La rigidité du cadre de prescription et d’accès au traitement (ex. : posologie déterminée à l’avance, heures d’ouverture des cliniques et des pharmacies, fréquence et distance des déplacements nécessaires, etc.), l’incompatibilité des objectifs de traitement proposés avec les intentions du patient (ex. : certains patients continuent de rechercher l’effet euphorisant des opioïdes à courte durée d’action) et la présence de stigma et d’attitudes négatives perçues ou vécues par les PUD de la part de certains professionnels envers ce type de traitement peuvent contribuer à l’abandon ou à la crainte d’initiation d’un TAO (Bojko et al., 2016 ; Kourounis et al., 2016 ; Stöver, 2011).
Ces réalités, ainsi que le cadre restrictif de certains modèles de soins traditionnels que nous détaillerons plus tard dans cet article, pourraient expliquer le faible taux de rétention en TAO, en particulier pour les personnes présentant un TLUO plus sévère (Socías et al., 2018 ; Stark, 1992). Le faible taux de desserte à Montréal est également un élément préoccupant dans un contexte de crise d’opioïdes. Parmi l’ensemble des personnes qui devraient recevoir un TAO, seuls 36,0 % reçoivent un traitement alors que la proportion visée est de 70,0 % (Perreault et Archambault, 2017).
L’approvisionnement sécuritaire : une solution adaptée au cœur du problème ?
Face au taux de mortalité alarmant lié aux surdoses d’opioïdes et à la présence du fentanyl accrue dans les drogues de rue, de nombreux cliniciens, experts de santé publique de même que le gouvernement du Canada proposent maintenant de mettre en place des stratégies cliniques ou communautaires d’approvisionnement sécuritaire pour accroître l’accès à des alternatives aux drogues de rue pour les personnes qui ne souhaitent pas entreprendre de traitements ou qui n’adhèrent que partiellement aux traitements (Izenberg et Marwaha, 2019 ; Santé Canada, 2019a).
Mais concrètement, qu’est-ce que l’approvisionnement sécuritaire ? C’est un concept particulier à définir, car il ne s’agit pas d’un traitement unique et que l’ensemble des acteurs ne s’entend pas sur une définition. Trois caractéristiques semblent cependant se dégager des définitions proposées : l’objectif, la molécule choisie et, plus rarement, l’existence de données probantes justifiant la pratique.
L’Association canadienne des personnes qui utilisent des drogues (CAPUD) et l’Ontario HIV Treatment Network définissent l’approvisionnement sécuritaire en fonction des molécules utilisées, plus précisément celles qui ne sont « traditionnellement accessibles que par le marché illicite des drogues » et qui « ont des propriétés psychoactives » (CAPUD, 2019 ; Ontario HIV Treatment Network, 2020). Cette définition plus restrictive pose cependant quelques enjeux.
- L’accessibilité des drogues sur le marché illicite n’est pas figée dans le temps. Par exemple, la proportion des PUD montréalais qui rapportent s’injecter le plus souvent des médications opioïdes comme l’hydromorphone est passée de moins de 5,0 % à plus de 40,0 % entre 2003 et 2015 (DRSP, 2019).
- Certaines molécules traditionnellement accessibles par le marché illicite des drogues peuvent également être utilisées à titre de traitements (notamment les TAO à l’héroïne ou à l’hydromorphone injectable dont nous discuterons plus tard).
- La notion de « propriétés psychoactives » est subjective et certains peuvent ressentir des effets avec les TAO traditionnels.
À l’inverse, Santé Canada définit l’approvisionnement sécuritaire en fonction de l’objectif de la pratique. Dans sa classification, même les TAO traditionnels pourraient y être inclus « en abaissant les critères d’éligibilité, en se concentrant sur des objectifs centrés sur le patient, en mettant l’accent sur la réduction de la consommation de drogues illicites (et des méfaits qui y sont liés) et en utilisant une approche à bas seuil/réduction des méfaits pour donner accès à des alternatives d’opioïdes réglementés à l’approvisionnement en drogues illicites » (Santé Canada, 2019b). Cette définition pose cependant d’autres enjeux, car différents objectifs peuvent coexister au sein de certains modèles de soins ou se succéder chez une même personne.
Finalement, certains cliniciens définissent l’approvisionnement sécuritaire comme l’ensemble des pratiques émergentes qui ne sont pas appuyées par des données probantes. Selon cette logique, lorsqu’une pratique est appuyée par des données probantes, elle s’inscrit dès lors dans le domaine thérapeutique (Bromley, 2020 ; Willows et al., 2020). Cela pose d’autres enjeux, la littérature médicale étant en évolution constante.
En bref, le TAO traditionnel n’est généralement pas considéré comme une forme d’approvisionnement sécuritaire (seulement dans certaines conditions selon le cadre de Santé Canada), alors que le TAO injectable (TAOi) est considéré comme une forme d’approvisionnement par la plupart des parties prenantes (notamment, par Santé Canada et les principales associations de patients) bien que certains cliniciens et guides de pratiques cliniques le classent comme un traitement (Bromley, 2020 ; Bruneau et al., 2018 ; CAPUD, 2019 ; Ontario HIV Treatment Network, 2020 ; Santé Canada, 2019b ; Willows et al., 2020). Le Tableau 1 résume et compare les principales approches discutées dans l’article.
Pour notre part, nous définirons l’approvisionnement sécuritaire comme un éventail de stratégies visant à fournir des substances de qualité pharmaceutique qui ne sont accessibles principalement que par le marché illicite, et ce, sans viser nécessairement l’arrêt de la consommation ou la modification de la voie d’administration, afin de réduire le risque de surdose lié à l’imprévisibilité des drogues de rues.
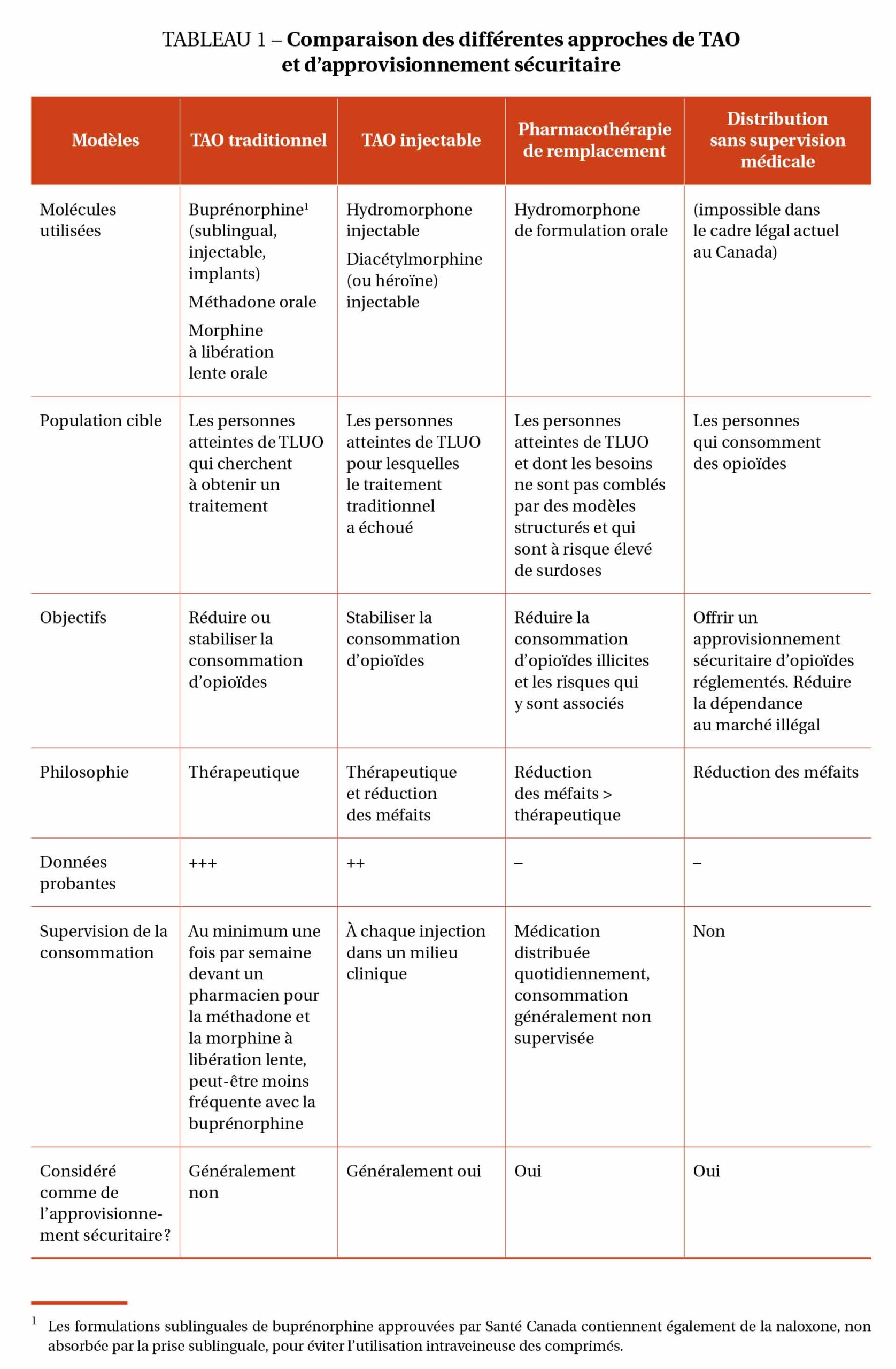
Ces différentes approches répondent à différents degrés aux logiques du contrôle des drogues illicites dites « thérapeutique » ou de « réduction des méfaits » tel que proposées par Carrier et Quirion (2003). Alors que la logique thérapeutique prend sa source dans une conception biomédicale de ce qui est défini comme un « trouble lié à l’usage de substances » et cherche à en réduire la « symptomatologie », la logique de réduction des méfaits vise à réduire les risques causés par l’usage des drogues illicites, sans viser à pathologiser l’usage des drogues. Cela dit, les auteurs notent que les interventions ancrées dans une logique de réduction des méfaits pourraient favoriser involontairement la stigmatisation des PUD qui n’adoptent pas les pratiques de réduction des méfaits, pouvant devenir considérés comme des « vecteurs de risque » pour la société (Carrier et Quirion, 2003).
Dans un autre ordre d’idées, l’adoption graduelle et récemment accélérée de la logique de réduction des méfaits dans les milieux cliniques – initialement par des initiatives de distribution de matériel de consommation stérile, puis maintenant avec les approches d’approvisionnement sécuritaire – est parfois caractérisée comme une institutionnalisation du domaine de la réduction des méfaits et une appropriation par le domaine médical d’une philosophie qui trouve ses origines dans des mouvements grass roots (Gillet et Brochu, 2005). Cependant, notons que le cadre légal actuel oblige la distribution d’opioïdes de qualité pharmaceutique dans un cadre médical. Les autres modèles de distribution communautaire (sous forme de clubs d’acheteurs ou de compassion), qui existent pour la distribution du cannabis médical, demeurent illégaux à ce jour (Santé Canada, 2019b).
Au-delà des enjeux conceptuels, force est de reconnaître que l’épidémie des surdoses d’opioïdes et la pandémie de COVID-19 a donné un élan au développement d’approches cliniques moins rigides, plus près d’une logique de réduction des méfaits, qui partagent la caractéristique de ne pas viser l’arrêt de la consommation. Nous discuterons des deux principales approches d’approvisionnement sécuritaire au Canada : le TAOi et la pharmacothérapie de remplacement.
Les données probantes soutenant l’approvisionnement sécuritaire
Les études scientifiques démontrant l’efficacité de l’approvisionnement sécuritaire pour réduire les surdoses ou pour augmenter la rétention en traitement sont peu nombreuses à ce jour et ont souvent étudié des modalités de traitement difficilement applicables en pratique.
Les principales études qui ont évalué l’efficacité de l’approvisionnement sécuritaire se sont surtout concentrées sur le TAOi, c’est-à-dire la prescription médicale d’héroïne et d’hydromorphone injectables. On retrouve de la littérature médicale sur l’utilisation de l’héroïne comme traitement médical des TLUO depuis les années 1970 (Koran, 1973). Cette pratique, plus largement étudiée à partir des années 1980 en Europe sur des populations réfractaires aux TAO traditionnels, avait montré des effets bénéfiques à plusieurs niveaux, mais aussi soulevé rapidement des enjeux éthiques, sociaux et politiques (Bammer et al., 1999 ; Hartnoll et al., 1980 ; March et al., 2006 ; McCusker et Davies, 1996 ; Perneger et al., 1998). Le premier essai clinique nord-américain sur le TAOi, l’étude NAOMI, menée au Canada entre 2005 et 2008, démontrait que l’héroïne injectable était plus efficace que la méthadone pour maximiser la rétention en traitement et réduire la criminalité chez les patients ayant échoué au moins deux TAO précédemment (Oviedo-Joekes et al., 2009). Par la suite, plusieurs autres études ont corroboré ces résultats et une revue de la littérature de 2015 concluait que l’utilisation d’héroïne prescrite dans un contexte d’injection supervisée est efficace pour prendre en charge les patients dépendants aux opioïdes réfractaires aux traitements standards (Strang et al., 2015).
L’essai clinique SALOME, réalisé en 2016, a démontré pour sa part que l’hydromorphone injectable est aussi efficace que l’héroïne injectable prescrite pour réduire l’usage d’héroïne illicite chez les utilisateurs chroniques. Cette étude avait été réalisée dans le contexte où la prescription médicale d’héroïne au Canada et dans d’autres pays n’était alors pas possible, ou très compliquée, malgré son efficacité prouvée (Oviedo-Joekes et al., 2016).
En somme, la prescription médicale d’opioïdes de courte action comme l’héroïne ou l’hydromorphone a fait ses preuves dans le traitement du TLUO réfractaire au traitement standard. Ces modalités de traitement où chaque injection se fait dans un contexte supervisé sont cependant peu adaptées à la réalité du terrain et présentent de nombreuses barrières d’-accès. Les traitements injectables requièrent que la personne se déplace au moins deux fois par jour, tous les jours, et plusieurs normes légales et pharmaceutiques complexifient la distribution. Il est donc difficile de rejoindre une population sur un territoire plus large, et cela rend difficile l’accès aux personnes qui ont un emploi. Bien qu’ils soient démontrés efficaces, la Ville de Vancouver constate encore une crise des surdoses même avec l’implantation de TAOi (Office of the Provincial Health Officer, 2019).
Dans ce contexte, des modèles complémentaires au TAOi, comme la pharmacothérapie de remplacement des opioïdes de rue, ont été considérés par des acteurs du milieu médical et communautaire afin de rejoindre rapidement une plus grande proportion de personnes qui consomment des opioïdes et qui restent à risque (BC Centre on Substance Use, 2020 ; Institut universitaire sur les dépendances, 2020).
Bien qu’il n’existe pas à ce jour de littérature scientifique documentant les bénéfices de la pharmacothérapie de remplacement des opioïdes, les partisans de cette approche soutiennent que cette stratégie pourrait permettre de diminuer le risque de surdoses associées à l’imprévisibilité de la composition des drogues de rue et d’augmenter l’initiation et la -rétention en traitement, en particulier chez les patients qui n’ont pas connu de succès avec les traitements conventionnels ou qui ne sont pas prêts à renoncer à l’effet des opioïdes à action rapide (CAPUD, 2019 ; Ontario HIV Treatment Network, 2020).
La pharmacothérapie de remplacement en pratique
Les barrières d’accès aux traitements du TLUO sont bien connues depuis plusieurs années. C’est du désir de maximiser l’initiation et la rétention en traitement des PUD que sont nées les cliniques dites « à bas seuil d’exigences » qui tentent de mitiger ces barrières en offrant un cadre plus adapté pour les personnes au statut plus marginal au début des années 2000. Les cliniques avec une approche à bas seuil se distinguent généralement des cliniques standards en facilitant l’admission en traitement (ex. : critères d’admission en traitement plus souples, listes d’attentes courtes, horaires flexibles, etc.) et en proposant un cadre de traitement plus flexible et adapté à l’individu (ex. : pluralité d’options de traitement, flexibilité quant aux exigences de suivis par les professionnels, à la durée du traitement ou à la gestion des rechutes, etc.) (Kourounis et al., 2016).
Les caractéristiques des approches à bas seuil d’exigences qui ont montré leur efficacité incluent notamment (Edland-Gryt et Skatvedt, 2013 ; Kourounis et al., 2016) :
- la réduction des listes d’attentes ;
- la personnalisation du choix ;
- la durée flexible du traitement ;
- une plus grande tolérance aux rechutes et à l’usage de drogues illicites ;
- une moins grande supervision de la prise du traitement.
Ces constats, issus principalement des expériences européennes, ont permis d’améliorer la prise en charge thérapeutique des troubles liés à l’utilisation de substances et de mieux définir les modalités d’organisation des soins en dépendance au Québec, en particulier avec les populations vulnérables. Nous détaillerons ici l’approche de la clinique Relais, puis rapporterons notre expérience clinique avec certains patients chez qui une pharmacothérapie de remplacement des opioïdes a été initiée.
L’expérience de la pharmacothérapie de remplacement des opioïdes à la clinique Relais
La clinique Relais offre un service d’accès à bas seuil d’exigence pour des personnes avec un TLUO en situation de grande précarité depuis 1999. Tous les patients sont pris en charge par une équipe multidisciplinaire et sont accompagnés dans leur traitement avec un soutien psychosocial, des mesures de réduction des méfaits et un médecin traitant pour l’ensemble des conditions médicales, reliées ou non à l’usage de substances psychoactives. Maintenant localisée dans l’hôpital Notre-Dame depuis début 2020, la clinique est en processus d’implantation du premier TAOi au Québec.
Dans une optique d’approche à bas seuil d’exigences et de réduction des méfaits dans le contexte de la crise des surdoses, les professionnels de la clinique ont cherché à offrir des alternatives aux personnes qui continuent d’utiliser des opioïdes de rue. Il faut comprendre que les TAO comme la méthadone ou la morphine à libération lente ne sont pas prescrits à dose fixe ou avec des incrémentations de dose prévisibles. La posologie de ces molécules doit être individualisée et peut prendre plusieurs semaines à ajuster. Pendant ce temps, les personnes en traitement continuent d’avoir recours au marché illicite pour éviter les symptômes de sevrage. Cette période d’augmentation progressive de la dose décourage plusieurs patients, surtout ceux qui font usage de grandes quantités d’opioïdes pour qui cela peut durer jusqu’à huit semaines. De plus, nombreuses sont les personnes qui continuent de consommer malgré le traitement, et ce, pour de multiples raisons.
Ainsi, depuis 2019, les médecins de la clinique ont recours à la pharmacothérapie de remplacement des opioïdes, sous forme d’hydromorphone en comprimé, lorsqu’il est jugé que les bénéfices de la prescription outrepassent les risques de surdose. Dans le cadre légal actuel, la prescription médicale de pharmacothérapie en remplacement constitue le moyen le plus simple et le plus rapide de rendre accessible l’approvisionnement sécuritaire. La rationnelle de cette pratique, déjà initiée dans les provinces canadiennes plus durement affectées par la crise des opioïdes, est basée sur la démonstration de l’efficacité de l’hydromorphone injectable dans le traitement du trouble d’usage des opioïdes, mais également la complexité d’accès aux traitements injectables. Depuis, plus de la moitié des patients de la clinique ont bénéficié de prescription médicale d’opioïdes en complément de leur traitement standard, lors de la période de titration ou sur une période à plus long terme, et la grande majorité des nouveaux patients en reçoivent dès le début de leur traitement.
Nous présentons l’histoire clinique de trois personnes chez qui une pharmacothérapie de remplacement a été introduite qui nous semblent représentatives de l’expérience à Relais. Les informations rapportées ont été recueillies par les auteurs de l’article lors de rencontres cliniques et par la révision des dossiers avec l’approbation des patients. Afin de respecter la confidentialité, les noms des patients ont été modifiés.
Cas 1
Chantal est une femme dans la cinquantaine qui a commencé l’usage d’opioïdes et de cocaïne dans la trentaine par voie intraveineuse. Elle a débuté un premier traitement à la méthadone il y a un peu plus de dix ans. Après une stabilisation initiale les premières années, elle a eu un parcours difficile, parsemé de périodes d’itinérance, de multiples rendez-vous manqués et de périodes prolongées sans suivi. Elle a déjà fait deux endocardites nécessitant une chirurgie majeure et de longs séjours à l’hôpital. Elle a, par moment, besoin de faire du trafic pour subvenir à ses besoins de base. Dans ses traitements antérieurs, même si elle réussissait à réduire considérablement sa consommation d’opioïdes, elle continuait activement l’injection de cocaïne.
Il y a quelques mois, elle est réadmise en traitement. Elle admet d’emblée qu’elle a beaucoup de difficulté à faire le deuil de l’injection et que les envies de consommer sont toujours présentes et jamais complètement comblées. Elle rapporte alors une consommation d’environ 200 mg d’hydromorphone de rue par jour, en plus de la cocaïne, pour laquelle on s’attend à ce que la méthadone ne soit pas suffisante pour atteindre rapidement une dose de confort. Une pharmacothérapie de remplacement d’hydromorphone lui est proposée pour l’ajustement initial de son dosage et la méthadone est augmentée jusqu’à 90 mg. Après une franche discussion sur ses enjeux et objectifs, il est décidé de poursuivre la pharmacothérapie de remplacement au long cours avec son TAO. Sa dose de méthadone est ultimement réduite à 50 mg à sa demande et après discussion pour qu’elle puisse sentir l’effet de l’hydromorphone, bloqué à haute dose de méthadone. Cette démarche a beaucoup diminué ses préoccupations et la pression liée au traitement usuel et elle a depuis cessé l’usage des opioïdes de rue et réduit considérablement celui de la cocaïne à environ une fois par semaine plutôt qu’à tous les jours. Elle suit toutes les recommandations pour une injection sécuritaire et se présente à ses rendez-vous beaucoup plus facilement que dans le passé. Elle n’a plus besoin de faire du trafic pour payer sa consommation et elle a comme objectif de graduellement diminuer et éventuellement cesser l’injection. Elle souhaite profiter de cette nouvelle période de vie pour prendre soin de ses enjeux de santé négligés au fil des années et elle a repris contact avec son fils et sa famille.
Cas 2
Steven est un homme dans la trentaine faisant usage des opioïdes et de l’alcool qui est connu de la clinique depuis 2008. Pendant près de 10 ans, il a été suivi de manière intermittente avec un traitement de méthadone par épisodes de quelques mois à chaque fois, interrompus par des absences de plusieurs mois. Sa consommation lui a causé de plusieurs problèmes de santé, notamment, une hépatite alcoolique, une pancréatite alcoolique et une infection à hépatite C.
Au cours de l’été 2019, il revient consulter à la clinique à la suite d’un séjour de quelques années à l’extérieur du Québec. Il est alors sans domicile fixe. Un TAO traditionnel est entamé mais, en l’espace de quatre mois, il est interrompu à cinq reprises. Au printemps 2020, il rapporte avoir commencé à consommer de l’hydromorphone de rue et une première tentative de pharmacothérapie de remplacement est tentée, mais cessée plus tard puisque le patient avait l’intention de déménager à l’extérieur du Québec.
Au cours de l’été 2020, sa consommation augmente drastiquement jusqu’à un gramme d’héroïne injectée par jour en plus de sa dose de 60 mg de méthadone. Malgré une augmentation de sa dose de méthadone qui lui permet initialement de réduire sa consommation, il commence à consommer de l’héroïne mauve et fait plusieurs surdoses sur une période de deux mois, dont une ayant nécessité un transport à l’urgence et une autre ayant nécessité l’administration de naloxone. Il a également dû utiliser la naloxone sur deux de ses amis consommateurs. Il a peur de mourir, mais ne souhaite pas que sa méthadone soit augmentée davantage en raison des effets secondaires sexuels. On ajuste donc légèrement sa méthadone et on lui ajoute une pharmacothérapie de remplacement qui sera ajustée par la suite puis maintenue stable quelques mois.
À l’automne 2020, son TAO de méthadone est changé pour un TAO de morphine à libération lente uniquotidienne. Présentant moins d’effets secondaires avec ce traitement, il réussit à augmenter sa dose, pour pouvoir réduire et éventuellement cesser la pharmacothérapie de remplacement. Maintenant suivi sans interruption depuis plus d’un an, il s’agit du plus long suivi continu de ce patient et cette période de stabilité lui a permis de réduire sa consommation d’alcool, retrouver un logement et ultimement un emploi. Il a également débuté un traitement pour son hépatite C et il ne consomme plus d’opioïdes de rue.
Cas 3
Michel est dans le début trentaine et est suivi à la clinique depuis cinq ans. Pendant les quatre premières années, il fait huit tentatives de traitements de buprénorphine/naloxone ou de méthadone, mais ne se présente jamais suffisamment longtemps pour atteindre une dose avec laquelle il est confortable. Son plus long suivi durant cette période est de trois -rendez-vous consécutifs avec une dose maximale de méthadone de 80 mg par jour.
En décembre 2019, il entame un nouveau suivi. Il rapporte à ce moment une consommation d’un demi-gramme d’héroïne injectée par jour et on tente une stratégie de pharmacothérapie de remplacement surajoutée à la méthadone. Progressivement sur quatre mois, le traitement de méthadone est augmenté jusqu’à 125 mg, alors que les comprimés d’hydromorphone sont diminués jusqu’à être complètement cessés. Il reste par la suite confortable au cours d’une période de neuf mois consécutifs pour la première fois pendant laquelle son hépatite C est traitée.
À l’automne 2020, le patient rechute dans le contexte du décès d’un proche et revient à la clinique après avoir cessé son traitement pendant une dizaine de jours en rapportant une consommation encore plus grande avec cette fois du fentanyl surajouté. Cette fois-ci, lors du dosage de la méthadone, la pharmacothérapie de remplacement sera augmentée de manière plus agressive que la première fois puisque sa tolérance semble plus grande jusqu’à ce qu’il retrouve un confort qui lui permette de cesser complètement sa consommation d’opioïdes de rue. Par la suite, la méthadone est progressivement dosée alors que les comprimés d’hydromorphone seront progressivement retirés tout en maintenant son confort.
Bénéfices observés et enjeux
Malgré plusieurs craintes initiales des prescripteurs, l’approvisionnement sécuritaire d’opioïdes sous forme de pharmacothérapie de remplacement, réalisé dans un cadre clinique global permettant une prise en charge des autres aspects médicaux et psychosociaux, nous semble présenter plusieurs avantages qui vont bien au-delà de la réduction du risque de surdose.
L’équipe qui utilise cette nouvelle pratique voit d’abord une opportunité d’avoir un franc dialogue sur les objectifs du suivi. La traditionnelle réponse « je veux arrêter de consommer » à l’entrée en traitement devient plus nuancée et centrée sur la personne, plutôt que sur ce qu’elle pense qui est attendu d’elle. L’adaptation du traitement à un haut niveau d’adéquation aux besoins du patient permet d’établir plus rapidement une relation de confiance (Marchand et al., 2020). Celles qui avaient de la difficulté à se présenter tous les jours à la pharmacie pour prendre leur traitement ont une plus grande assiduité, et cela permet d’ajuster plus rapidement leur traitement et ainsi optimiser leur confort. L’augmentation de la rétention en traitement chez ces patients souvent plus socialement désaffiliés permet d’augmenter les contacts avec les professionnels de la santé, ce qui donne l’opportunité de travailler d’autres aspects liés à la qualité de vie ou à la réinsertion sociale (ex. : traitement d’autres conditions de santé, recherche de logement, enseignement de techniques d’injection à moindre risque, etc.) (Flores-Aranda et Goyer, 2020 ; Perreault et al., 2007). Une étude ethnographique a mis en lumière que la pharmacothérapie de remplacement améliore la santé et le bien-être des participants, en diminuant le recours à l’injection, en améliorant la prise en charge de la douleur, et en réduisant le stress et les dépenses liées à l’achat de substances psychoactives, ce qui diminue la poursuite d’activités criminelles (Ivsins et al., 2021). Ses impacts positifs vont ainsi bien au-delà de la diminution de la consommation de substances de rue et elle pourrait également favoriser la transition vers un TAO traditionnel, comme cela a été observé pour le TAOi (Rehm et al., 2001).
Cette pratique n’est pas sans soulever d’enjeux. Les premiers à considérer sont d’ordre légal et professionnel, puisque l’indication reconnue de l’hydromorphone en comprimé est le traitement de la douleur, surtout aiguë. Les médecins qui proposent cette pratique doivent s’assurer que les bénéfices outrepassent les risques et aviser leurs patients qu’elle n’est conforme à aucun cadre de pratique officielle à ce jour. Le consentement éclairé peut d’ailleurs être un défi pour certaines personnes qui se présentent souvent intoxiquées ou qui ont des conditions de santé mentale instables. Les médecins doivent aussi discuter des enjeux de trafic puisque certains peuvent être tentés de revendre ou de partager leurs comprimés prescrits. Bien que dans une perspective de santé publique, on puisse être rassuré que des comprimés de qualité pharmaceutique soient en circulation plutôt que des comprimés contrefaits potentiellement dangereux, la revente reste un acte illégal et place les personnes à risque d’incarcération. Dans ce contexte, le prescripteur se place ici dans une situation où il doit pallier un manque d’accès communautaire à des substances plus sécuritaires, et cela peut soulever des enjeux éthiques (par exemple, si une personne admet donner une partie de sa prescription à un ami qui ne veut pas entrer en traitement, mais qui a fait plusieurs surdoses en lien avec une consommation de fentanyl).
Le praticien qui entame une prescription d’opioïdes de remplacement doit composer avec un guide flou entourant les doses de départ et maximales, ainsi que les combinaisons optimales avec les médicaments utilisés en TAO. Comme avec les TAO, une période d’ajustement de dosage reste nécessaire. La visée doit rester le bien-être et l’amélioration des conditions de vie, tout en restant sécuritaire. Les équipes sont régulièrement confrontées à la dualité entre les objectifs médicaux et ceux des personnes rencontrées. Cette pratique a en effet mis en lumière le désir encore très présent de certains patients de continuer à sentir les effets euphorisants des opioïdes, qui peuvent souhaiter diminuer leur dose de TAO usuel pour recevoir davantage de doses d’hydromorphone. Cette opposition apparente dans les objectifs de traitement peut pousser certains cliniciens à remettre en question les limites de l’approche centrée sur le patient et de l’approche paternaliste, ainsi que leurs valeurs. Le dialogue peut être difficile avec certaines personnes, mais ultimement, l’éthique biomédicale et la déontologie exigent que le médecin s’assure de l’effet positif des traitements qu’il prescrit, entre autres sur les déterminants de la santé (logement, emploi, intégration sociale), tout en minimisant leurs effets négatifs. Toutefois, cette balance entre les bénéfices et les risques de la prescription de comprimés d’hydromorphone et les risques liés à l’absence de traitement peut s’avérer difficile dans des cas plus complexes et soulever des enjeux éthiques et professionnels. En cas de non-atteinte des objectifs de traitement ou de surdoses dans un contexte de polyconsommation, doit-on poursuivre ou cesser la prescription ? Dans tous les cas, ces discussions seront une occasion de travailler sur les démarches de réinsertion et la prise en charge médicale de d’autres pathologies.
Le développement d’approches d’approvisionnement sécuritaire dans des cadres médicalisés pourrait également accentuer les barrières d’accès et les inégalités de santé. L’accès aux soins médicaux étant déjà difficile, voir un médecin pour une prescription d’hydro-morphone à des fins de consommation sécuritaire pourra se révéler impossible pour certains. Dans plusieurs cadres cliniques, cette pratique pourrait être réservée aux personnes qui ont démontré des échecs antérieurs aux traitements traditionnels (ex. : persistance de la consommation, rechutes répétées, etc.). Bien que ce critère soit mis en place afin de s’assurer de ne pas aggraver un trouble d’usage, cette limite peut porter préjudice aux personnes en situation d’extrême précarité qui en ont possiblement le plus besoin. De la même façon, les critères mis en place pour rejoindre les personnes qui ont acquis une dépendance établie excluent les personnes qui font un usage récréatif des opioïdes, qui restent à risque de surdose, d’autant plus qu’ils n’ont souvent pas la tolérance acquise par les consommateurs réguliers. Dans un autre ordre d’idées, la plus grande intensité du suivi requis par les stratégies d’approvisionnement sécuritaire pourrait miner l’accès aux traitements. Ces enjeux organisationnels mettent également en lumière la nécessité de réfléchir attentivement au cadre dans lequel cette pratique doit être réalisée. Alors qu’au Québec la pharmacothérapie de remplacement est généralement délivrée à la pharmacie quotidiennement pour une consommation non supervisée, d’autres modèles existent, notamment en Colombie-Britannique, où la distribution peut être multiquotidienne via des machines distributrices et la supervision de la consommation peut être exigée (Olding et al., 2020 ; Tyndall, 2020). Les avantages et les inconvénients de ces différents cadres doivent continuer d’être étudiés.
Malgré toutes ces considérations, les professionnels qui ont commencé à utiliser la pharmacothérapie de remplacement des opioïdes restent convaincus de sa portée, bien qu’elle reste limitée à ce jour, et plusieurs intervenants du milieu clinique croient même que l’accès à des opioïdes de qualité pharmaceutique devrait être libéralisé. À terme, des évaluations formelles devront être réalisées pour documenter l’efficacité de cette pratique pour réduire la consommation d’opioïdes illicites, prévenir les surdoses, augmenter la rétention en traitement et améliorer la qualité de vie.
Vers de l’approvisionnement sécuritaire en contexte communautaire ?
La crise des opioïdes restera un enjeu majeur de santé publique tant que des mesures structurantes et adaptées au cœur du problème ne seront pas mises en place. Le contexte actuel doit nous appeler à repenser nos objectifs et nos stratégies dans la lutte aux dépendances. Sans des efforts soutenus pour s’attaquer aux causes profondes de l’utilisation non médicale des opioïdes – les inégalités socioéconomiques, l’isolement, le manque d’accès aux soins de santé – les efforts intensifs de suppression de l’offre qui ont permis l’émergence du fentanyl sur le marché illicite continueront de favoriser des alternatives plus mortelles et moins coûteuses. D’ici là, une approche basée sur la réduction des méfaits comme l’approvisionnement sécuritaire nous apparaît comme une manière supplémentaire de diminuer l’importante mortalité et morbidité associée à l’usage des opioïdes de rue.
Bien que la pharmacothérapie de remplacement des opioïdes de rue soit la forme la plus rapide à implanter d’approvisionnement sécuritaire pour l’instant au Canada, le cadre plus rigide qu’impose le contexte médical limite nécessairement l’accès aux opioïdes de qualité pharmaceutique. Pour éviter que les PUD se tournent vers un marché noir de plus en plus dangereux, des changements législatifs autorisant le déploiement de réseaux de distribution d’opioïdes de qualité pharmaceutique dans la communauté sans supervision médicale sont une option qui devrait certainement être envisagée.
Références
Agence de la santé publique du Canada. (2020, juin). Décès apparemment liés à la consommation d’opioïdes – Surveillance des méfaits associés aux opioïdes au Canada – janvier 2016 à décembre 2019. https://sante-infobase.canada.ca/mefaits-associes-aux-substances/opioides
Armenian, P., VO, K. T., Barr-Walker, J. et Lynch, K. L. (2018). Fentanyl, fentanyl analogs and novel synthetic opioids: a comprehensive review. Neuropharmacology, 134, 121‑132. https://doi.org/10.1016/j.neuropharm.2017.10.016
Bammer, G., Dobler-Mikola, A., Fleming, P. M., Strang, J. et Uchtenhagen, A. (1999). The heroin prescribing debate: integrating science and politics. Science, 284(5418), 1277-1278. https://doi.org/10.1126/science.284.5418.1277
BC Centre on Substance Use. (2020). Risk Mitigation in the Context of Dual Public Health Emergencies. https://www.bccsu.ca/wp-content/uploads/2020/04/Risk-Mitigation-in-the-Context-of-Dual-Public-Health-Emergencies-v1.5.pdf
Beletsky, L. et Davis, C. S. (2017). Today’s fentanyl crisis: Prohibition’s Iron Law, revisited. International Journal of Drug Policy, 46, 156‑159. https://doi.org/10.1016/j.drugpo.2017.05.050
Bojko, M. J., Mazhnaya, A., Marcus, R., Makarenko, I., Islam, Z., Filippovych, S., Dvoriak, S. et Altice, F. L. (2016). The future of opioid agonist therapies in Ukraine: a qualitative assessment of multilevel barriers and ways forward to promote retention in treatment. Journal of substance abuse treatment, 66, 37‑47. https://doi.org/10.1016/j.jsat.2016.03.003
Bromley, L. A. (2020). Problems with hydromorphone prescribing as a response to the opioid crisis. CMAJ, 192(9), E219‑E220. https://doi.org/10.1503/cmaj.74065
Bruneau, J., Ahamad, K., Goyer, M.-È., Poulin, G., Selby, P., Fischer, B., Wild, T. C. et Wood, E. (2018). Management of opioid use disorders: a national clinical practice guideline. CMAJ, 190(9), E247‑E257. https://doi.org/10.1503/cmaj.170958
Canadian Association of People who Use Drugs. (2019). Safe supply – Concept document. Canadian Association of People who Use Drugs. https://vancouver.ca/files/cov/capud-safe-supply-concept-document.pdf
Carrier, N. et Quirion, B. (2003). Les logiques de contrôle de l’usage des drogues illicites : la réduction des méfaits et l’efficience du langage de la périllisation. Drogues, santé et société, 2(1), 1-29. https://doi.org/10.7202/007181ar
Centre canadien sur les dépendances et l’usage de substances. (2020). Adultérants, contaminants et substances cooccurrentes dans les drogues obtenues illégalement au Canada (Bulletin du RCCET). https://www.ccsa.ca/fr/adulterants-contaminants-et-substances-cooccurrentes-dans-les-drogues-obtenues-illegalement-bulletin
Ciccarone, D. (2017). Editorial for “US heroin in transition: supply changes, fentanyl adulteration and consequences” IJDP special section. The International journal on drug policy, 46, 107. https://dx.doi.org/10.1016%2Fj.drugpo.2017.06.010
Collège des médecins du Québec. (2020). Le traitement du trouble lié à l’utilisation d’opioïdes (TUO). http://www.cmq.org/publications-pdf/p-1-2020-03-20-fr-le-traitement-du-trouble-lie-a-l-utilisation-
d-opioides-tuo.pdf
College of Physicians and Surgeons of Newfoundland and Labrador. (2020). Opioid Agonist Treatment (OAT) Guidance During the COVID-19 Pandemic. https://www.crismquebecatlantic.ca/wp-content/uploads/2020/05/1.-college-of-physicians-and-surgeons-of-newfoundland-labrador_oat-guidance-during-the-covid-19.pdf
Connery, H. S. (2015). Medication-assisted treatment of opioid use disorder: review of the evidence and future directions. Harvard review of psychiatry, 23(2), 63‑75. https://doi.org/10.1097/hrp.0000000000000075
Degenhardt, L., Whiteford, H. et Hall, W. D. (2014). The Global Burden of Disease projects: What have we learned about illicit drug use and dependence and their contribution to the global burden of disease? Drug and Alcohol Review, 33(1), 4‑12. https://doi.org/10.1111/dar.12088
Direction régionale de la santé publique de Montréal. (2018). Projet d’analyse de drogues dans l’urine de personnes qui utilisent des drogues – août 2018 – Résultats sur la présence de fentanyl. Centre intégré universitaire de santé et de services sociaux du Centre-Sud-de-l’Ile-de-Montréal. http://cran.qc.ca/sites/default/files/projet_analyse_drogues_dans_urine_aout-sept._2018_resultats_finaux.pdf
Direction régionale de la santé publique de Montréal. (2019). Le volet montréalais du réseau SurvUDI [communication par affiche]. Présentation interne, Montréal. https://santemontreal.qc.ca/fileadmin/fichiers/professionnels/DRSP/sujets-a-z/ITSS/Affiche_SurvProject_Mars-2019.pdf
Direction régionale de la santé publique de Montréal. (2020a). Risque de surdoses liées à la consommation de fentanyl dans de la poudre cristalline mauve vendue comme de l’héroïne. Santé Montréal. https://liferay6.cess-labs.com/documents/69080/80600/Alerte+Surdose_2020-06-12.pdf/4ff1c4a2-70b0-4b7e-aece-6f4f7e46b328?version=1.0
Direction régionale de la santé publique de Montréal. (2020b). Risque de surdoses liées à la consommation de fentanyl et d’héroïne. Santé Montréal. https://liferay6.cess-labs.com/documents/69080/80600/Alerte+Surdose_2020-07-02.pdf/daf64bce-c733-45b6-a5be-f57d8126099b?version=1.0
Direction régionale de la santé publique de Montréal. (2020c). Risque de surdoses liées à la consommation de fentanyl. Santé Montréal. https://santemontreal.qc.ca/population/coronavirus-covid-19/actualites/nouvelle/hausse-importante-de-deces-par-surdose-de-drogues-crack-cocaine-amphetamines-ghb-a-montreal/
Direction régionale de la santé publique de Montréal. (2020d). Hausse importante des surdoses sévères et décès liés à la consommation de drogues de rue à Montréal : deux phénomènes concomitants préoccupants. Santé Montréal. https://santemontreal.qc.ca/fileadmin/fichiers/professionnels/DRSP/appel-vigilance/2020/AAV_Surdoses_20200806.pdf
Direction régionale de la santé publique de Montréal. (2020e). Risque de décès liés à la consommation de cocaïne contenant du fentanyl. CIUSSS du Centre-Est-de-l’Île-de-Montréal. https://liferay6.cess-labs.com/documents/69080/80600/Alerte+surdose_7+octobre+2020.pdf/b9fdae49-2ea2-41d2-8b02-792eaeb3d81e?version=1.0
Direction régionale de la santé publique de Montréal. (2020f). Risque de décès liés à la consommation de comprimés contenant de l’isotonitazène. Santé Montréal. https://santemontreal.qc.ca/professionnels/drsp/actualites/nouvelle/risque-de-deces-lies-a-la-consommation-de-comprimes-contenant-de-lisotonitazene/
Edland-Gryt, M. et Skatvedt, A. H. (2013). Thresholds in a low-threshold setting: An empirical study of barriers in a centre for people with drug problems and mental health disorders. International Journal of Drug Policy, 24(3), 257‑264. https://doi.org/10.1016/j.drugpo.2012.08.002
Fischer, B., Jones, W., Tyndall, M. et Kurdyak, P. (2020). Correlations between opioid mortality increases related to illicit/synthetic opioids and reductions of medical opioid dispensing-exploratory analyses from Canada. BMC Public Health, 20(1), 1‑7. https://doi.org/10.1186/s12889-020-8205-z
Fischer, B., Pang, M. et Jones, W. (2020). The opioid mortality epidemic in North America: do we understand the supply side dynamics of this unprecedented crisis? Substance Abuse Treatment, Prevention, and Policy, 15(1), 1‑8. https://doi.org/10.1186/s13011-020-0256-8
Flores-Aranda, J. et Goyer, M.-È. (2020). Guide québécois d’amélioration des pratiques sur la prise en charge du trouble lié à l’utilisation des opioïdes (TUO). Institut universitaire sur les dépendances. http://dependanceitinerance.ca/wp-content/uploads/2020/04/GuideTUO-FR-2020.pdf
Gillet, M. et Brochu, S. (2005). Institutionnalisation des stratégies de réduction des méfaits au sein de l’agenda politique canadien : les enjeux et les limites de la conceptualisation actuelle. Drogues, santé et société, 4(2), 79‑139. https://doi.org/10.7202/012601ar
Gisev, N., Bharat, C., Larney, S., Dobbins, T., Weatherburn, D., Hickman, M., Farrell, M. et Degenhardt, L. (2019). The effect of entry and retention in opioid agonist treatment on contact with the criminal justice system among opioid-dependent people: a retrospective cohort study. The Lancet Public Health, 4(7), e334‑e342. https://doi.org/10.1016/s2468-2667(19)30060-x
Gouvernement du Canada. (2017). Loi sur les bons samaritains secourant les victimes de surdose. https://laws-lois.justice.gc.ca/fra/loisAnnuelles/2017_4/
Gouvernement du Canada. (2020). Faire face à la crise des opioïdes au Canada. https://www.canada.ca/fr/sante-canada/services/dependance-aux-drogues/consommation-problematique-medicaments-ordonnance/opioides/repondre-crise-opioides-canada.html
Gowing, L. R., Farrell, M., Bornemann, R., Sullivan, L. E. et Ali, R. L. (2006). Brief report: Methadone treatment of injecting opioid users for prevention of HIV infection. Journal of general internal medicine, 21(2), 193‑195. https://doi.org/10.1111/j.1525-1497.2005.00287.x
Hartnoll, R. L., Mitcheson, M. C., Battersby, A., Brown, G., Ellis, M., Fleming, P. et Hedley, N. (1980). Evaluation of heroin maintenance in controlled trial. Archives of General Psychiatry, 37(8), 877‑884. https://doi.org/10.1001/archpsyc.1980.01780210035003
Institut national de santé publique du Québec. (2020). Décès reliés à une intoxication suspectée aux opioïdes ou autres drogues au Québec. Gouvernement du Québec. https://www.inspq.qc.ca/substances-psychoactives/opioides/surdose/deces-intoxication/intoxication-suspectee
Institut universitaire sur les dépendances. (2020). La pharmacothérapie de remplacement des substances psychoactives dans le contexte de pandémie de COVID-19 au Québec : Guide clinique à l’intention des prescripteurs. CIUSSS du Centre-Sud-de-l’Île-de-Montréal. http://dependanceitinerance.ca/wp-content/uploads/2020/10/Version-en-ligne-2020.
10.20guide-pharmaco-long_VF.pdf
Ivsins, A., Boyd, J., Mayer, S., Collins, A., Sutherland, C., Kerr, T. et McNeil, R. (2021). “It’s Helped Me a Lot, Just Like to Stay Alive”: a Qualitative Analysis of Outcomes of a Novel Hydromorphone Tablet Distribution Program in Vancouver, Canada. Journal of Urban Health, 98(1), 59‑69. https://doi.org/10.1007/s11524-020-00489-9
Izenberg, D. et Marwaha, S. (2019), 15 août. Safe supply: the debate around prescribing opioids to people who use drugs. Healthy Debate. https://healthydebate.ca/2019/08/topic/safe-supply
Koran, L. M. (1973). Heroin maintenance for heroin addicts: issues and evidence. New England Journal of Medicine, 288(13), 654‑660. https://doi.org/10.1056/nejm197303292881305
Kourounis, G., Richards, B. D. W., Kyprianou, E., Symeonidou, E., Malliori, M.-M. et Samartzis, L. (2016). Opioid substitution therapy: lowering the treatment thresholds. Drug and alcohol dependence, 161, 1‑8. https://doi.org/10.1016/j.drugalcdep.2015.12.021
March, J. C., Oviedo-Joekes, E., Perea-Milla, E. et Carrasco, F. (2006). Controlled trial of prescribed heroin in the treatment of opioid addiction. Journal of substance abuse treatment, 31(2), 203‑211. https://doi.org/10.1016/j.jsat.2006.04.007
Marchand, K., Foreman, J., MacDonald, S., Harrison, S., Schechter, M. T. et Oviedo-Joekes, E. (2020). Building healthcare provider relationships for patient-centered care: A qualitative study of the experiences of people receiving injectable opioid agonist treatment. Substance abuse treatment, prevention, and policy, 15(1), 1‑9. https://doi.org/10.1186/s13011-020-0253-y
McCusker, C. et Davies, M. (1996). Prescribing drug of choice to illicit heroin users: the experience of a UK community drug team. Journal of substance abuse treatment, 13(6), 521‑531. https://doi.org/10.1016/s0740-5472(96)00155-9
Ministère de la Santé et des Services sociaux. (2018). Stratégie nationale 2018-2020 pour prévenir les surdoses d’opioïdes et y répondre. Gouvernement du Québec. https://publications.msss.gouv.qc.ca/msss/fichiers/2018/18-233-04W.pdf
National Institute on Drug Abuse. (2020). Opioid Agonist Treatment Reduces Societal Costs of Crime. https://www.drugabuse.gov/news-events/nida-notes/2017/08/opioid-agonist-treatment-reduces-societal-costs-crime
Office of the Provincial Health Officer. (2019). Stopping the Harm – Decriminalization of People who Use Drugs in BC. https://www2.gov.bc.ca/assets/gov/health/about-bc-s-health-care-system/office-of-the-provincial-health-officer/reports-publications/special-reports/stopping-the-harm-report.pdf
Olding, M., Ivsins, A., Mayer, S., Betsos, A., Boyd, J., Sutherland, C., Culbertson, C., Kerr, T. et McNeil, R. (2020). A low-barrier and comprehensive community-based harm-reduction site in Vancouver, Canada. American journal of public health, 110(6), 833‑835. https://doi.org/10.2105/AJPH.2020.305612
Ontario HIV Treatment Network. (2020). Possible benefits of providing safe supply of substances to people who use drugs during public health emergencies such as the COVID-19 pandemic. https://www.ohtn.on.ca/rapid-response-possible-benefits-of-providing-safe-supply-of-substances-to-people-who-use-drugs-during-public-health-emergencies-such-as-the-covid-19-pandemic/
Oviedo-Joekes, E., Brissette, S., Marsh, D. C., Lauzon, P., Guh, D., Anis, A. et Schechter, M. T. (2009). Diacetylmorphine versus methadone for the treatment of opioid addiction. New England Journal of Medicine, 361(8), 777‑786. https://doi.org/10.1056/nejmoa0810635
Oviedo-Joekes, E., Guh, D., Brissette, S., Marchand, K., MacDonald, S., Lock, K., Harrison, S., Janmohamed, A., Anis, A. H., Krausz, M., Marsh, D. C. et Schechter, M. T. (2016). Hydromorphone compared with diacetylmorphine for long-term opioid dependence: a randomized clinical trial. JAMA psychiatry, 73(5), 447‑455. https://doi.org/10.1001/jamapsychiatry.2016.0109
Pearce, L. A., Min, J. E., Piske, M., Zhou, H., Homayra, F., Slaunwhite, A., Irvine, M., McGowan, G. et Nosyk, B. (2020). Opioid agonist treatment and risk of mortality during opioid overdose public health emergency: population based retrospective cohort study. BMJ, 368, 1-13. https://doi.org/10.1136/bmj.m772
Perneger, T. V., Giner, F., del Rio, M. et Mino, A. (1998). Randomised trial of heroin maintenance programme for addicts who fail in conventional drug treatments. Bmj, 317(7150), 13‑18. https://doi.org/10.1136/bmj.317.7150.13
Perreault, M. et Archambault, L. (2017). Requis de services en matière de traitement des troubles liés à l’usage d’opioïdes sur l’île de Montréal. Centre de recherche et d’aide pour narcomanes (Cran) et Centre universitaire de santé et de services sociaux de l’Ouest-de-l’île-de-Montréal. http://cran.qc.ca/sites/default/files/documents/requis_de_service_rapport_final.pdf
Perreault, M., Héroux, M.-C., White, N. D., Lauzon, P., Mercier, C. et Rousseau, M. (2007). Rétention en traitement et évolution de la clientèle d’un programme montréalais de substitution à la méthadone à exigences peu élevées. Canadian journal of public health, 98(1), 33‑36. https://doi.org/10.1007/BF03405382
Rehm, J., Gschwend, P., Steffen, T., Gutzwiller, F., Dobler-Mikola, A. et Uchtenhagen, A. (2001). Feasibility, safety, and efficacy of injectable heroin prescription for refractory opioid addicts: a follow-up study. The Lancet, 358(9291), 1417‑1420. https://doi.org/10.1016/s0140-6736(01)06529-1
Santé Canada. (2017). Enquête canadienne sur le tabac, l’alcool et les drogues (ECTAD) : sommaire des résultats pour 2017. Gouvernement du Canada. https://www.canada.ca/fr/sante-canada/services/enquete-canadienne-tabac-alcool-et-drogues/sommaire-2017.html
Santé Canada. (2019a). Programme sur l’usage et les dépendances aux substances – Appel de propositions – Lignes directrices à l’intention des demandeurs – Juillet 2019. Gouvernement du Canada.
Santé Canada. (2019b). Toolkit for Substance Use and Addictions Program Applicants – Stream 2: Increasing Access to Pharmaceutical-Grade Medications. Gouvernement du Canada. https://stimulusconference.ca/wp-content/uploads/2020/09/Safe-Supply-Tool-Kit-2019_EN.pdf
Santé Canada. (2020). Federal actions on opioids to date. Gouvernement du Canada. https://www.canada.ca/content/dam/hc-sc/documents/services/substance-use/problematic-prescription-drug-use/opioids/responding-canada-opioid-crisis/federal-actions/june_2020_pager-FINAL_.pdf
Service d’analyse des drogues. (2020). Rapport sur les drogues analysées 2019 – Troisième trimestre (juillet à septembre 2019). Gouvernement du Canada. https://www.canada.ca/fr/sante-canada/services/preoccupations-liees-sante/substances-controlees-precurseurs-chimiques/service-analyse-drogues/2019-rapport-drogues-analysees-q3.html
Socías, M. E., Wood, E., Kerr, T., Nolan, S., Hayashi, K., Nosova, E., Montaner, J. et Milloy, M.-J. (2018). Trends in engagement in the cascade of care for opioid use disorder, Vancouver, Canada, 2006–2016. Drug and alcohol dependence, 189, 90‑95. https://doi.org/10.1016/j.drugalcdep.2018.04.026
Stark, M. J. (1992). Dropping out of substance abuse treatment: A clinically oriented review. Clinical psychology review, 12(1), 93‑116. https://doi.org/10.1016/0272-7358(92)90092-M
Stöver, H. (2011). Barriers to opioid substitution treatment access, entry and retention: a survey of opioid users, patients in treatment, and treating and non-treating physicians. European Addiction Research, 17(1), 44‑54. https://doi.org/10.1159/000320576
Strain, E. (2020, avril). Pharmacotherapy for opioid use disorder. UpToDate. https://www.uptodate.com/contents/pharmacotherapy-for-opioid-use-disorder
Strang, J., Groshkova, T., Uchtenhagen, A., van den Brink, W., Haasen, C., Schechter, M. T., Lintzeris, N., Bell, J., Pirona, A., Oviedo-Joekes, E., Simon, R. et Metrebian, N. (2015). Heroin on trial: systematic review and meta-analysis of randomised trials of diamorphine-prescribing as treatment for refractory heroin addiction. The British Journal of Psychiatry, 207(1), 5‑14.
Tsui, J. I., Evans, J. L., Lum, P. J., Hahn, J. A. et Page, K. (2014). Association of opioid agonist therapy with lower incidence of hepatitis C virus infection in young adult injection drug users. JAMA internal medicine, 174(12), 1974‑1981.
Tyndall, M. (2020). Safer opioid distribution in response to the COVID-19 pandemic. International Journal of Drug Policy, 83, 102880.
Willows, M., Brasch, J., Sobey, P., Tanguay, R. et Martell, D. (2020). Is All “Safe Supply” Safe? Canadian Journal of Addiction, 11(1), 30‑31.
Wood, E. (2018). Strategies for reducing opioid-overdose deaths—lessons from Canada. New England Journal of Medicine, 378(17), 1565‑1567.
Tous droits réservés © Drogues, santé et société, 2021







